Contenidos en este artículo
Hasta hace años, la industria farmacéutica, como el resto de las industrias, registraba la información generada durante el proceso productivo de forma manual, es decir, en papel. Sin embargo, hoy día los cuadernos de notas de laboratorio, las recetas maestras, las carpetas de ensayos clínicos. Los registros de lotes y procedimientos, entre otros, ya no se almacenan como documentos escritos o impresos, sino que se han digitalizado mediante la integridad de los datos.
La digitalización de los procesos farmacéuticos ha traído muchas ventajas como el hecho de poder encontrar datos más rápidamente y desde cualquier lugar o hacer copias de seguridad. Pero esta cultura digital también implica ciertos riesgos relacionados con la integridad de los datos en la industria farmacéutica.
Ingresar datos en sistemas electrónicos se está expuesto a errores humanos que podrían poner en peligro tanto la seguridad y la salud de los pacientes, como la continuidad de la empresa que fabrica los medicamentos, por ejemplo.
Por ello la industria farmacéutica debe seguir ciertos procedimientos que garanticen la integridad de los datos.
ALCOA, Una Estructura Clave para la Integridad de los Datos en la Industria Farmacéutica
El concepto ALCOA es común en la industria farmacéutica. Esta es una estructura básica recomendada por agencias regulatorias como la FDA y la EMA para asegurar la buena gestión de los datos.
Se trata de un marco importante que ayuda a las empresas a asegurar la calidad de la documentación relacionada a los productos farmacéuticos y a garantizar la integridad de la información que se genera de forma electrónica.
Según la guía “Data Integrity and compliance with cGMP” de la FDA, para cumplir con la integridad de los datos en la industria farmacéutica la información debe ser:
- (A) Atribuible: significa que debe quedar sentado quien creó el registro, cuándo y por qué. Asimismo, se debe saber si generación del dato fue por modificación o creación.
- (L) Legible: el registro debe ser permanente y comprensible. Además, debe estar accesible durante todo su ciclo de vida.
- (C) Contemporáneo: el registro debe realizarse en el momento en que se lleva a cabo una actividad. No hacerlo oportunamente podría afectar la precisión del registro, ya que hay detalles que se pueden olvidar.
- (O) Original: el primer registro del dato, con su contenido original, debe conservarse siempre.
- (A) Accurate (exactos, precisos): los datos no deben contener errores y además deben ser completos, veraces y reflejar de manera precisa la observación.
ALCOA, Check list para Auditoria
| ALCOA | Formato | Pregunta Data Integrity |
|
ATRIBUIBLE
| Papel | ¿Su empresa mantiene un registro de firmas para los empleados que trabajan en áreas GxP? |
| Papel | ¿Está el personal capacitado en Buenas Prácticas de Documentación que indiquen que los registros de GxP deben llevar las iniciales y la fecha? | |
| Papel | ¿El uso de escritura es frecuente en su empresa? | |
| Papel | ¿Están permitidas en su empresa las imágenes digitales de la firma manuscrita de una persona? | |
| Electrónico | ¿El sistema utiliza inicios de sesión de usuario únicos con firmas electrónicas? | |
| Electrónico | ¿Existen pruebas de auditoría que registren la identidad de los operadores que ingresan, cambian, confirman o eliminan datos? | |
| Electrónico | ¿El sistema identifica y registra a la persona que libera o certifica los lotes? ¿Se utiliza firma electrónica? | |
| Electrónico | ¿El personal está capacitado sobre los fundamentos de la integridad de los datos, lo que hace hincapié en no revelar nunca su nombre de usuario o contraseñas a otros miembros del personal? | |
|
Legible
| Papel | ¿Existen controles para garantizar que los datos se registren con tinta indeleble y permanente? |
| Papel | ¿Está prohibido el uso de corrector líquido, lápices y borradores? | |
| Papel | ¿Existe una emisión controlada de protocolos y compaginados para las actividades de GMP? | |
| Papel | ¿El archivo de registros en papel lo realiza un archivero designado independiente? | |
| Papel | ¿Están los operadores capacitados para usar tachaduras de una sola línea acompañadas de una inicial y una fecha cuando se registran los cambios en un registro? | |
| Electrónico | ¿Se verifican periódicamente sus datos almacenados para garantizar su legibilidad? | |
| Electrónico | ¿Son las pistas de auditoría convertibles a una forma generalmente inteligible? | |
| Electrónico | ¿Pueden los usuarios generales desactivar la pista de auditoría? | |
| Electrónico | ¿Se comprueba periódicamente la legibilidad de los datos archivados? | |
| Electrónico | ¿Se respaldan los datos de una manera que permita la reconstrucción de una actividad? | |
|
Contemporáneo
| Papel | ¿El personal está capacitado en Buenas Prácticas de Documentación y enfatiza la importancia de registrar las entradas de datos en el momento de la actividad? |
| Papel | ¿El personal está capacitado en Buenas Prácticas de Documentación y enfatiza que no es apropiado fechar o adelantar un registro? | |
| Electrónico | ¿Su sistema genera automáticamente una marca de tiempo cuando se ingresan los datos? | |
| Electrónico | ¿Las firmas electrónicas contienen una marca de tiempo generada automáticamente? | |
| Electrónico | ¿Los usuarios pueden cambiar las marcas de tiempo aplicadas a los registros? | |
| Electrónico | ¿Los usuarios generales pueden acceder y cambiar el reloj del sistema o la configuración de la zona horaria? | |
| Electrónico | ¿Se guardan los datos en ubicaciones de almacenamiento no autorizadas, como memorias USB? | |
| Electrónico | ¿Existe suficiente disponibilidad de terminales de usuario en el lugar donde tiene lugar una actividad GxP? | |
|
Original
| Papel | ¿Se permiten notas adhesivas u otros blocs de notas no oficiales en las áreas de GMP de la instalación? |
| Papel | ¿Las actividades de calificación / validación se realizan en protocolos originales preaprobados? | |
| Papel | ¿Existe un área controlada y segura para el archivo de registros? | |
| Papel | ¿Están los registros originales disponibles para inspección? | |
| Electrónico | ¿Es posible imprimir registros de liberación de lotes que muestren cualquier dato que haya sido modificado desde la entrada original? | |
| Electrónico | ¿Están sus firmas electrónicas vinculadas permanentemente a sus respectivos registros? | |
| Electrónico | ¿La persona que procesa los datos tiene la capacidad de influir en qué datos se informan o cómo se presentan? | |
| Electrónico | ¿El sistema evita la eliminación de datos originales? | |
| Electrónico | ¿Es posible tomar capturas de pantalla y usar herramientas de recorte para manipular datos? | |
| Electrónico | ¿Se revisan periódicamente los metadatos? | |
|
Preciso
| Papel | ¿Están formateados los formularios, los libros de registro y los cuadernos para permitir la entrada de datos correctos fácilmente? |
| Papel | ¿Existen procedimientos para revisar de forma independiente los registros en papel originales? | |
| Papel | ¿Se investigan las desviaciones y los resultados fuera de especificación? | |
| Papel | ¿Se calibran y mantienen los instrumentos de laboratorio? | |
| Papel | ¿Se realizan comprobaciones secundarias para comprobar la precisión de los datos críticos? | |
| Papel | ¿Se presiona al personal para que cumpla los objetivos de producción, lo que compromete la precisión de los registros? | |
| Electrónico | ¿Las interfaces contienen comprobaciones integradas para la entrada y el procesamiento de datos correctos y seguros? | |
| Electrónico | ¿Su sistema realiza una verificación de la precisión de las configuraciones y los datos críticos? | |
| Electrónico | ¿Se revisan periódicamente los sistemas? | |
| Electrónico | ¿Se validan las interfaces para demostrar la seguridad y no se dañan los datos? | |
| Electrónico | ¿Los datos archivados están protegidos contra modificaciones no autorizadas? |
Validación de Sistemas Computarizados, una Solución que Garantiza la Integridad de los Datos
La validación de sistemas computarizados es una exigencia obligatoria que comprende una evaluación de aspectos como software, hardware, firmware, procedimientos, equipos y personal.
Es una validación que garantiza la confiabilidad de la información de tu empresa a corto, mediano y largo plazo, tanto en el entorno de desarrollo, manufactura y producción como de almacenamiento y distribución.
Al no contar con una validación de sistemas computarizados, te expones a varios riesgos. Uno de ellos es enfrentar cargos penales por delitos contra la salud pública, y también tomar decisiones incorrectas por apoyarse en información que no es confiable.
Asimismo, puedes poner en riesgo vidas, perder clientes por falta de confianza e incluso limitar el desarrollo de la Industria por no acatar las buenas prácticas.
La experiencia en la ejecucion de una validación de CSV es fundamental, considerando que el improvisar puede triplicar el presupuesto, tiempo y posiblemente alcance de un proyecto para un sistema implementado o por implementar, considerando los siguientes pasos podemos detectar brechas:
Primero: Evaluar Criticidad del Sistema en Integridad de los Datos
- El sistema computarizado participa en la transferencia de insumos y/o producto?
- ¿El sistema computarizado participa en la disposición de insumos y/o producto (aprobación, rechazo, cuarentena, liberación al mercado, devolución, retiro, entre otros)?
- ¿El sistema computarizado participa en controles de proceso incluyendo condiciones ambientales en la producción y/o análisis de insumos y/o producto?
- ¿El sistema computarizado participa en controles de sistemas críticos?
- ¿El sistema computarizado o el equipo donde se encuentra, solicita el uso de una firma electrónica?
- ¿El sistema computarizado le permite establecer los parámetros o configuraciones del proceso según aplique (temperatura, velocidad, presión, tiempos de prueba, por ejemplo
Segundo: Preparación de la Validación
- ⮚Conocer el software y el hardware y su destino
- ⮚Listar URS
- ⮚Calificar la Infraestrura
- ⮚Calificar el Proveedor o Implementador ( ojo en el 90% de las validaciones esto no se considera)
- ⮚Verificar competencias de los involucrados con el sistema
Tercero: Clasificación de Sistema
Sistema categoría GAMP ®
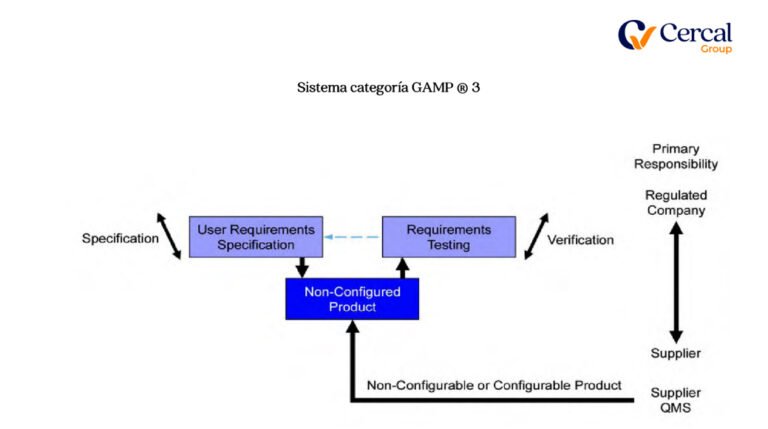
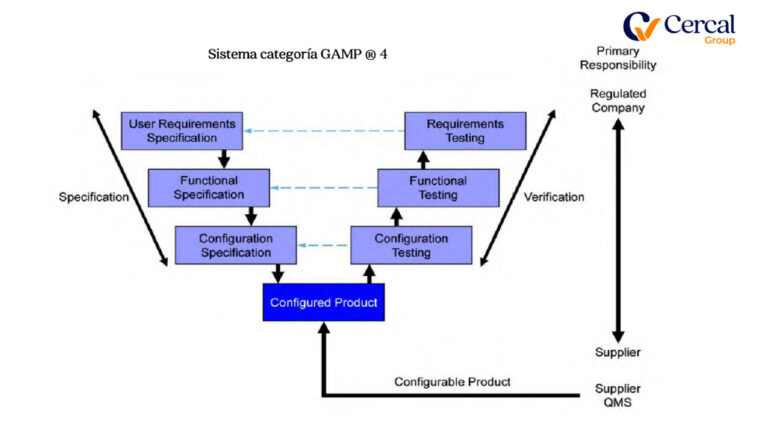
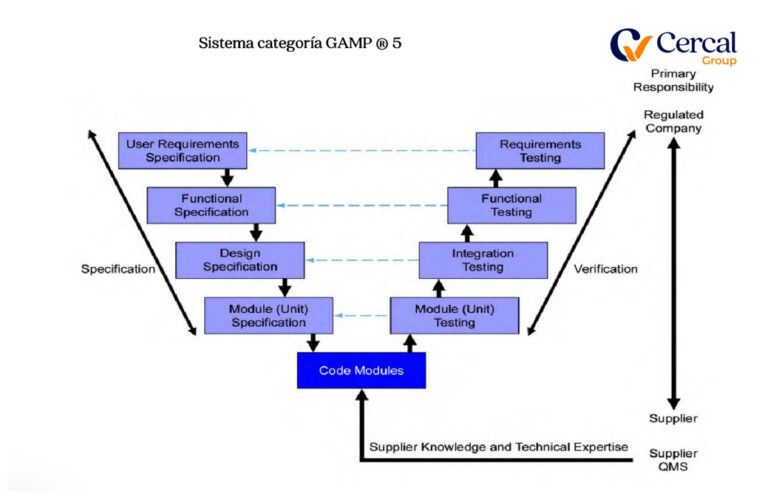
Cuarto: GAP´s Análisis de Documental y Software
Evaluación de Plan Maestro de Validación de Sistemas Computarizados cubrirá la política para la validación de;
- Sistemas de Gestión de la Información
- Sistemas de aplicaciones de Laboratorio
- Sistemas de Control de Proceso.
- Hojas de tratamiento de datos (Hojas Excel)
Evaluación de documentos y políticas TI
- Continuidad del negocio y recuperación en caso de desastres
- Gestión de la configuración y control de cambios e incidentes
- Gestión de copias de seguridad y restauración de sistemas computarizados
- Seguridad e integridad de los datos
- Retención, archivo, recuperación y borrado de registros de sistemas computarizados
- Revisión de Audit Trail
- Revisión periódica de sistemas computarizados
- Seguridad de sistemas computarizado
Quinto: Definición de URS, Análisis de Riesgo y Especificaciones Funcionales
⮚Mesas de trabajo para generar los URS Funcionales del Sistema
⮚USR de Seguridad
⮚Controles de Cambio
⮚Interfaces con Usuarios, Sistemas, equipos y aplicaciones
⮚Ambiente operativo
⮚Infraestructura de Comunicaciones
⮚Condiciones Fisicas y ambientales
⮚Errores, fallas o problemas
⮚URS de Compatibilidad, Disponibilidad
Sexto: Elaboración y Ejecución de Documentación Para Ejecucion de Test Cases (DQ, IQ, OQ, PQ)
Séptimo: Cierre Matriz de Trazabilidad y Proyecto
Después de ejecutar mas de 90 proyectos en LATAM con mas de 1800 software validados sabemos que como dice Dr Montgomery Lee “Los proyectos fracasan mucho menos de lo que pensamos pero mucho más de lo que creemos”
LOS 10 PECADOS CAPITALES DE LAS ESTIMACIONES (Steve McConolly) que me encuentro en casi el 99% de proyectos de CSV en América Latina
- Estimar cuánto durará un proyecto de CSV antes de identificar el software y los aspectos documentales.
- Crear la estimación de un proyecto de CSV en función de otro que se desvío y basarse en los resultados estimados en lugar de usar los resultados reales ( Experiencia KPI)
- Crear estimaciones sin considerar las necesidades de formación, reuniones, vacaciones, enfermedades, etc…
- Crear estimaciones de gran nivel de precisión soportadas por un bajo nivel de exactitud (67,3453 días +/- 2 meses)
- Confundir las estimaciones con los objetivos Decir “si” cuando en realidad se quiere decir “no”. Queremos lograr algo que no es posible, y lo compramos conscientes que no se lograra
- Calcular las estimaciones demasiado pronto, antes de un GAP´s análisis real
- Sobre-estimar los ahorros producidos por nuevas herramientas, métodos de trabajo, proveedores. Elegir lo mas barato o lo mas rápido) gastando el triple al final del proyecto
- No utilizar software de estimación ni información basada en históricos
- No incluir el impacto de los riesgos y controles de cambios en las estimaciones.
¡No improvises y trabaja con nosotros!
Garantizando la Integridad de los Datos con Cercal Group -Compromiso con la Excelencia en Inspección, Certificación y Más

En Cercal Group, entendemos la importancia crítica de mantener la integridad de los datos en todas nuestras operaciones. Nuestro equipo está profundamente comprometido con los principios de Buenas Prácticas Documentales e Integridad de Datos. Esto se refleja en cada uno de nuestros servicios de Inspección/Certificación, Validaciones, Auditorías y CSV.
Nos aseguramos de que todos los datos confidenciales sean manejados con el máximo cuidado, garantizando su seguridad y protección en todo momento.
Nuestros servicios están diseñados para prevenir la pérdida de datos y minimizar el error humano a través de controles de acceso rigurosos. Solo las personas autorizadas pueden acceder a registros de datos específicos, lo que asegura que la información crítica esté protegida y sea accesible solo para quienes la necesitan.
Implementamos sistemas avanzados de seguridad de datos, incluyendo protecciones contra pérdidas de fuente de alimentación, para garantizar que los datos precisos y confiables estén siempre disponibles para la toma de decisiones basadas en evidencia.
La integridad de los datos es el núcleo de nuestra promesa a los clientes. Con un enfoque proactivo hacia la protección de datos, nuestro equipo trabaja incansablemente para asegurar que cada dato manejado cumpla con los más altos estándares de precisión y confiabilidad.
A través de auditorías internas regulares y validaciones meticulosas, nos esforzamos por mantener y mejorar continuamente nuestros sistemas y procesos.
En Cercal Group, la integridad de los datos no es solo una parte de nuestros servicios; es la base sobre la que se construye toda nuestra operación. Nos dedicamos a asegurar que cada cliente reciba servicios de la más alta calidad, donde la seguridad y precisión de los datos sean siempre la prioridad.
Conclusión
La integridad de los datos es fundamental en la era digital, especialmente cuando se trata de proteger la información crítica. Las bases de datos son el corazón de los sistemas informáticos modernos, y su seguridad y coherencia son esenciales para la toma de decisiones efectiva.
Para ello, el control de acceso se presenta como una medida indispensable, asegurando que solo el personal autorizado tenga acceso a datos personales y corporativos.
Además, la integridad referencial en las bases de datos garantiza que las relaciones entre los datos se mantengan consistentes, evitando discrepancias que podrían afectar negativamente las operaciones empresariales.
Las auditorías internas juegan un papel crucial en la verificación de la integridad de los datos, identificando posibles vulnerabilidades y asegurando que las fuentes de datos sean fiables y estén protegidas contra amenazas externas, como cortes de energía o ataques cibernéticos.
Estas prácticas no solo protegen la información valiosa sino que también refuerzan la confianza de los stakeholders en la gestión de datos de la empresa.
En conclusión, la integridad de los datos es un pilar esencial para cualquier organización que dependa de la información digital.
A través de la implementación de sistemas de base de datos robustos, políticas de control de acceso efectivas y un régimen de auditorías internas, las empresas pueden asegurar la precisión, consistencia y seguridad de sus datos, fundamentales para una toma de decisiones informada y eficaz.


2 thoughts on “Cómo Garantizar la Integridad de los Datos en la Industria Farmacéutica a Través de Proyectos CSV Exitosos”