Contenidos en este artículo
¿Qué es la ICH?
ICH significa (International Conference on Harmonization) esta nació de la necesidad básica de unificar conceptos. En específico los requisitos técnicos para el registro de productos farmacéuticos de uso humano. El desarrollo de esta armonización comenzó en 1980 con Europa que posteriormente iniciaría un diálogo con Estados Unidos y con Japón. Para 1990 estos diálogos dieron su fruto dando inicio a las conferencias internacionales de armonización.
De esta forma estos sectores industriales tomaron el liderazgo en la producción de medicamentos. Obteniendo un doble beneficio la racionalización en el uso de recursos animales, humanos y también materiales para el desarrollo de nuevos medicamentos. Así como la reducción del tiempo de disposición de un nuevo medicamento en el mercado.
De este acercamiento entre las tres regiones es que se hace posible la identificación de divergencias en los requisitos que mediante acuerdos se consiguen armonizar. Esto se ve representado mediante el establecimiento de un método de trabajo común visto en forma de guías aplicables para la industria farmacéutica y las entidades regulatorias de cada país.
¿Cuál es la estructura de la ICH?
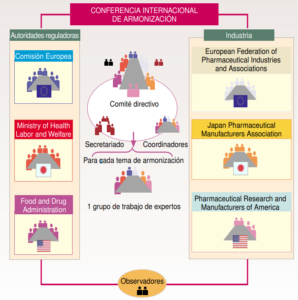
La estructura de la ICH se compone por varios patrocinadores entre los que se encuentran la comisión europea, la FDA, la PhRMA entre otras. Cabe destacar que en los años más recientes se dio la entrada de COFEPRIS como representante latinoamericano por parte de México. Un avance muy destacado pues la entrada a la ICH es compleja tanto así que en 2017 esta misma organización intentó entrar pero sin éxito.
También existe un grupo de entidades que hacen su función como observadores y enlace con países que no sean miembros de la ICH. Estos serían la OMS, IFPMA y las entidades reguladoras de Canadá y Suiza. Según esta estructura cada uno cumple una función la cual sería:
- Comité directivo: Está formado por un total de 12 miembros (dos miembros de cada uno de los seis grupos patrocinadores). Sus principales funciones son las de determinar la política y los procedimientos de la ICH, seleccionar los temas de armonización y monitorizar el seguimiento de las iniciativas ICH.
- Coordinadores: Los forman un miembro de cada uno de los seis grupos ICH. La función del coordinador es la de asegurar que los documentos son distribuidos de forma correcta y a las personas adecuadas mediante el contacto directo con el secretariado.
- Secretariado: Es responsable de la preparación de las reuniones del comité directivo y su documentación, de la coordinación de las reuniones de los grupos de trabajo y la preparación de la documentación técnica de las conferencias y de la relación con los conferenciantes.
- Grupos de trabajo: Para cada tema de armonización seleccionado, el comité directivo designa un grupo de trabajo (Expert Working Group, EWG) para revisar las diferencias existentes entre Europa, Estados Unidos y Japón y alcanzar un consenso científico.
¿Qué debe tener un medicamento para cumplir la guía de la ICH?
Para poder armonizar de forma correcta los requisitos técnicos para el registro de productos farmacéuticos. Es necesario generar unas categorías que respondan a las exigencias de todos los entes regulatorios estas son calidad, seguridad, eficacia y multidisciplinaria.
CALIDAD: Están codificados con una Q (Quality) y un número asignado a un tema, actualmente existen 14Q. En esta categoría encontraremos temas sobre aspectos químicos, farmacéuticos y biológicos del medicamento.
SEGURIDAD: Se codifican con la letra S (Safety) actualmente existen 12S.En esta categoría encontraremos temas sobre estudios preclínicos in vitro e in vivo.
EFICACIA: Se codifican con la letra E(Efficacy) Actualmente existen 20E.En esta categoría encontraremos temas sobre estudios clínicos en humanos.
MULTIDISCIPLINARIO: Se codifican con la letra M (Multidisciplinary) A est clasificación pertenecen las directrices que no están relacionadas con las anteriores.
“La armonización de los requisitos técnicos para productos farmacéuticos es crucial para la eficiencia global en la salud”
Claudia Velasco
CEO Cercal Group
Con estas categorías y sus temarios. Conseguir la armonización es una realidad que cada dos años se revisa para hacerle los ajustes pertinentes. Según lo discutido con los entes reguladores de todo el mundo. Pero especialmente de las potencias mundiales que lideran la ICH, pero hay un elemento más que aporta a esta armonización y es el CTD.
CTD (The Common Technical Document)
Este documento fue un antes y después ya que lo que pretende es unificar las categorías mencionadas anteriormente. Como un dossier validado a escala mundial el CTD es un aporte gigante para las empresas de la industria farmacéutica.
El CTD se organiza en 5 módulos, donde el primero trabaja los ítems específicos para cada región (o que no hacen parte del CTD). Como información administrativa e información de prescripción. El segundo resúmenes del CTD, el tercero trabaja la calidad , cuarto informes sobre los estudios pre-clínicos y el quinto informes sobre los estudios clínicos. Del 2 al 5 pretenden ser directrices comunes para todas las regiones (que hacen parte del CTD).
Normativa ICH Q9, la herramienta ideal para la correcta gestión de riesgos
La ICH Q9 es la directriz para la gestión de riesgos de calidad. Su objetivo es brindar una guía. Así como casos prácticos y herramientas de gestión de riesgos para aplicar a la industria farmacéutica.
Si quieres asegurarte de que tu empresa cumple con esta normativa, con nuestro servicio de Consultoría Farmacéutica – Validaciones y calificaciones podrás hacerlo. Aplicamos todo el proceso de gestión de riesgo para identificar, controlar, resolver y comunicar posibles fallas. Contáctanos para que puedas aplicar acciones correctivas y preventivas en este importante sector.
Conclusión
La implementación de las guías ICH ha marcado un punto de inflexión en la industria farmacéutica global. Estas directrices, centradas en la armonización de estándares para la calidad, seguridad y eficacia de los medicamentos, han facilitado un marco regulatorio más coherente y eficiente. El CTD, como componente integral de este proceso, ha revolucionado la forma en que las empresas farmacéuticas presentan sus datos regulatorios, permitiendo una revisión más rápida y efectiva de los productos farmacéuticos.
“El CTD representa un hito en la estandarización de la documentación farmacéutica a nivel internacional”
Raúl Quevedo
COO Cercal Group
Este enfoque unificado no solo ha mejorado la disponibilidad de medicamentos seguros y efectivos en el mercado mundial, sino que también ha reducido significativamente la duplicación de esfuerzos en los estudios clínicos y preclínicos. En última instancia, la adopción de las guías ICH y el CTD refleja un compromiso continuo con la mejora de la salud pública a nivel internacional, asegurando que los pacientes reciban tratamientos basados en los más altos estándares de calidad y seguridad.
La ICH sigue siendo un pilar fundamental en la evolución constante de la industria farmacéutica, guiando su camino hacia un futuro más seguro y eficiente en el cuidado de la salud.