Contenidos en este artículo
Validación de sistemas informáticos
Para la seguridad de los procesos en la industria farmacéutica la FDA recomienda que los sistemas relacionados en la producción sean validados para asegurar que fue diseñado de forma correcta y que está cumpliendo su objetivo, garantizando la integridad y la seguridad del procesamiento de los datos, la calidad del producto y el cumplimiento de la normativa en buenas prácticas.
Para validar que un sistema está cumpliendo con su labor se califican varios ítems conocidos como IQ (Calificación de Instalación), OQ (Calificación de Operaciones) y PQ (Calificación de Performance) También se validan dos aspectos, la integridad de datos que se establece mediante los atributos ALCOA+ y también la gobernanza de datos.
En este blog no vamos a profundizar al completo sobre todo el proceso de validación, aún así te dejamos un link hacia la guía de validación de la FDA que puedes revisar después de leer este blog.
Enfocando la documentación hacia el pensamiento crítico
La FDA siempre está en diálogo con los stakeholders de la industria juntos llegaron a la conclusión de que poner a prueba el software no es suficiente para generar la confianza suficiente para su uso, por eso afirma que es momento de generar una aproximación basada en la gestión de riesgo pero sobre todo en el pensamiento crítico
Desde lo práctico se propone que se prioricen las acciones necesarias para garantizar la calidad sobre el proceso de documentación que en muchos casos genera que el procesos de validación sea mucho más lento, cabe aclarar que la documentación es un elemento fundamental de este proceso ya que el registro da cuenta de las pruebas realizadas en el desarrollo de la validación.
¿Lo anterior significa que ahora se hacen menos pruebas?
Al contrario de lo que podría parecer lo que se busca priorizando el pensamiento crítico es aplicar más pruebas con menos documentación, centrándose de esta forma mucho más en la solución del problema optimizando los tiempos de la validación para transformarlo en cambio y mejora para su empresa.
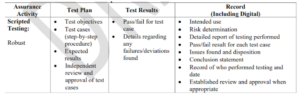
La documentación sigue siendo parte del proceso pero se pide que no incluya más evidencias de las necesarias para demostrar la característica, función u operación del sistema según el riesgo identificado, de hecho recomiendan un modelo de documentación que cabe aclarar sigue en Draft pero que puede ser tenido en cuenta a futuro.
En este formato se hace registro de la actividad a revisar, el plan de acción, sus resultados y el registro de los mismos.
El pensamiento crítico invita a pensar en la calidad
Con este nuevo enfoque la FDA evalúa la característica, función u operación según el riesgo y las consecuencias que puede tener sobre el paciente final, esto quiere decir que si una falla genera una consecuencia tangible en el proceso y en la calidad se le considera de alto riesgo y debe ser priorizada según el nuevo enfoque como ejemplo de esto tenemos:
- Fallas en mantener los parámetros del proceso (por ejemplo, temperatura, presión o humedad) que afectan las propiedades físicas del producto o procesos de fabricación que se identifican como esenciales a la seguridad o calidad del dispositivo.
- Fallas que impidan medir, inspeccionar, analizar y/o determinar la aceptabilidad del producto o proceso con conciencia o revisión humana limitada o nula
- Fallas que produzcan instrucciones de uso erróneas para pacientes o usuarios en las etiquetas necesarias.
Así mismo aquellas fallas que no alteran directamente la calidad y no generan una consecuencia sobre el paciente o usuario son tomadas de bajo riesgo, tal como:
- Fallas que no permitan recopilar y registrar datos del proceso con fines de seguimiento y revisión que no tienen un impacto directo en la producción o el rendimiento del proceso.
- Fallas de registro que no permitan monitorear o automatizar el proceso según el sistema de calidad.
Para concluir la FDA recomienda que en los procesos de alto riesgo se utilicen pruebas y registros más robustos y que determinen las acciones correctivas en contraste con lo anterior si el riesgo es bajo se pueden pruebas de tipo Ad-hoc donde la prueba no requiere de extensas cantidades de documentación y registro para ser solucionada y aprobada.
Desde tu perspectiva ¿Qué enfoque crees que es el más efectivo para las necesidades de tu empresa? Te hacemos dos recordatorios, el primero de ellos es que el CSA por ahora es un borrador, es decir el CSV continúa siendo el principal enfoqué de validación informática, lo segundo es que si requieres de asesoría o capacitación puedes contactar con nosotros, somos expertos en materia regulatoria y nuestro equipo de validación en sistemas computarizados esta listo para asistirte.