Contenidos en este artículo
En la industria farmacéutica, la calificación de equipos es fundamental para asegurar la eficacia y seguridad de los medicamentos que llegan a los consumidores. Estos procesos no solo representan un compromiso con la calidad, sino que también son esenciales para cumplir con las rigurosas normativas y estándares internacionales. A través de la calificación se asegura que los equipos y sistemas operen de manera adecuada, formando una barrera de seguridad que garantiza que cada producto farmacéutico en el mercado haya pasado por rigurosos controles de calidad. La calificación en la industria farmacéutica es esencial para la confianza de los pacientes, con la finalidad de alcanzar su mayor bienestar.
Claudia Velasco
CEO Cercal Group
“El impacto de la calidad en la industria farmacéutica es inmenso. Nos inspira a hacer una diferencia real en la vida de las personas y a contribuir a un futuro más saludable para todos.”
¿Qué es la Calificación de Equipos en la Industria Farmacéutica?
La calificación es un subconjunto de la validación. Se refiere a la acción de demostrar que cualquier proceso, equipo o actividad específica funcionará correctamente y conducirá al resultado esperado. Es esencialmente una verificación de que “estás fabricando el producto correctamente”.
La calificación de equipos en términos prácticos es la verificación de una lista de parámetros que permiten corroborar que el equipo cuenta con unos estándares para lograr cumplir con el propósito final. Esta calificación está acompañada de una revisión previa de análisis de riesgo. Asimismo, esta práctica permite demostrar que el equipo es apropiado para el uso propuesto en la producción de los productos.
Es importante resaltar que con la calificación de equipos, se valida que su funcionamiento está de acuerdo con las especificaciones establecidas tanto por el usuario y proveedor, cumpliendo así con las normas vigentes.
La calificación se centra en los procesos y equipos utilizados en su fabricación. Por ejemplo, un equipo podría estar calificado para operar a ciertas temperaturas, pero es el proceso de validación el que garantiza que esas temperaturas produzcan un medicamento seguro y eficaz.
Otra diferencia clave es su aplicación es la validación, que se aplica a lo largo de todo el proceso de fabricación, desde la adquisición de materias primas hasta la distribución del producto final. En cambio, la calificación se aplica a etapas específicas, como la instalación de un nuevo equipo o la implementación de un nuevo proceso, esto sería básicamente sus diferencias principales.
Tanto la validación como la calificación son esenciales en la industria farmacéutica, garantizan que los medicamentos y otros productos sean no solo efectivos, sino también seguros para el consumo. Sin embargo, es crucial entender sus diferencias y cómo se complementan entre sí para garantizar la máxima calidad en la producción farmacéutica.
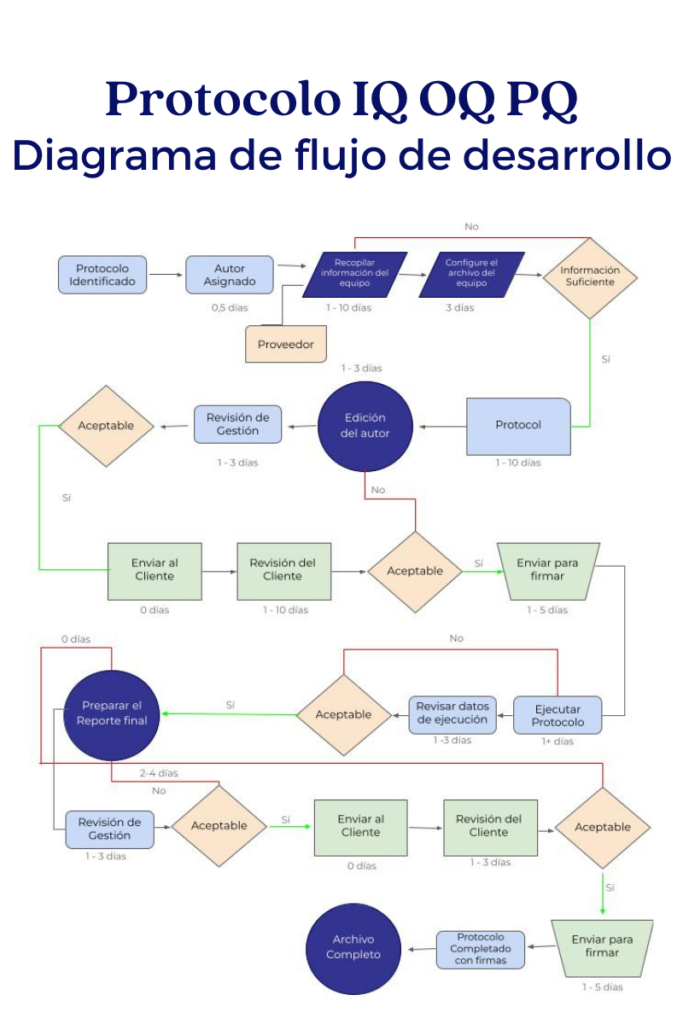
La calificación debe tener un orden cronológico desde la calificación de diseño, instalación, operación y desempeño, las desviaciones que se puedan presentar sobre cada uno de los estados de calificación deben ser cerradas para continuar con la siguiente calificación.
Etapas de la Calificación de Equipos
La calificación de equipos y sistemas es en sí un proceso meticuloso y esencial para garantizar su eficiencia y seguridad. A continuación, se detallan las etapas clave que componen este proceso:
PQ – Calificación de desempeño: Corresponde a la verificación del funcionamiento normal del equipo de manera operacional, con un producto a fabricar en donde se corrobora que el producto a obtener cumple con requerimientos establecido.
DQ – Calificación de diseño: Se realiza una revisión antes de la compra del equipo, con un grupo interdisciplinario que está acompañado por el área que va a hacer uso del equipo y las demás, que prestan el apoyo como: mantenimiento, aseguramiento de la calidad, compra, entre otros, para definir especificaciones, ubicación y metodología de ingreso de equipo. Esta calificación es puesta en marcha sobre un equipo nuevo.
IQ – Calificación de Instalación: Es la revisión de cumplimiento sobre los requerimientos de usuarios previos a la compra, verificación de la documentación del equipo y verificación definida por el grupo interdisciplinario. Esta calificación es un punto clave para continuar con la operación y desempeño porque se pueden identificar a tiempo incumplimientos que pueden llegar a retrasar aspectos de los siguientes estados de la calificación.
OQ – Calificación de operación: Consiste en la verificación operacional del equipo, este debe cumplir con una serie de verificaciones operacional en el que indique que este trabaja correctamente a escala operacional.
¿Por qué se Debe Hacer la Calificación de Equipos en Industria Farmacéutica?
La validación y calificación en la industria farmacéutica son fundamentales para garantizar la calidad y seguridad de los medicamentos. Estas prácticas aseguran que los productos cumplan con estándares rigurosos y sean aptos para el consumo humano.
Termina siendo un método para establecer evidencia documentada que permite demostrar que se tiene un alto grado de seguridad de que el proceso de fabricación producirá consistentemente un producto de calidad predeterminada, por lo que debe ser realizada por el fabricante.
Beneficios de la Calificación
- Seguridad del Paciente: Un equipo mal calificado puede dar lugar a productos de calidad inferior, lo que puede poner en riesgo la salud del paciente. Por lo tanto, es una parte esencial de las buenas prácticas de fabricación (GMP) en la industria farmacéutica.
- Aseguramiento de Calidad: La validación verifica que un proceso, sistema o actividad produce consistentemente un resultado deseado. Asegura que los medicamentos sean efectivos y seguros para su uso previsto. Sin validación, no hay garantía de que un medicamento funcione como se espera.
Normativas que Exigen la Calificación
La calificación de equipos en la industria farmacéutica está regulada por diversas normativas internacionales y nacionales que aseguran que los procesos de producción cumplan con los estándares de calidad y seguridad requeridos. Estas normativas incluyen:
- Buenas Prácticas de Manufactura (GMP): Las GMP son un conjunto de normas y directrices establecidas por organizaciones internacionales como la Organización Mundial de la Salud (OMS) y agencias regulatorias nacionales, como la FDA en Estados Unidos y la EMA en Europa. Las GMP requieren que los fabricantes validen y califiquen sus equipos y procesos para asegurar que los medicamentos se produzcan consistentemente con calidad adecuada.
- Guía de Calificación y Validación de la OMS: Esta guía proporciona principios generales para la calificación y validación en la industria farmacéutica. Incluye directrices específicas sobre la calificación de equipos, como la calificación de diseño (DQ), calificación de instalación (IQ), calificación de operación (OQ) y calificación de desempeño (PQ). Estas etapas deben ser documentadas y realizadas siguiendo un enfoque basado en riesgos.
- FDA 21 CFR Parte 211: Esta regulación establece los requisitos para la fabricación, procesamiento, empaque y almacenamiento de medicamentos en Estados Unidos. Incluye secciones específicas sobre la calificación de equipos para asegurar que cumplan con los estándares establecidos y produzcan medicamentos seguros y eficaces.
- Guías de la Agencia Europea de Medicamentos (EMA): La EMA proporciona guías detalladas sobre la calificación y validación de equipos en la fabricación de productos farmacéuticos. Estas guías aseguran que los equipos utilizados en la producción de medicamentos cumplan con los requisitos de calidad y seguridad establecidos por la Unión Europea.
- Normas ISO: Las normas ISO, como la ISO 9001, proporcionan un marco para los sistemas de gestión de calidad que incluye la calificación de equipos. Estas normas aseguran que los procesos de fabricación sean consistentes y cumplan con los requisitos de calidad internacionales.
- Directrices de la ICH (Conferencia Internacional sobre Armonización de Requisitos Técnicos para el Registro de Productos Farmacéuticos para Uso Humano): Las guías ICH, como la Q7 sobre buenas prácticas de manufactura para ingredientes farmacéuticos activos, también incluyen requisitos para la calificación de equipos y sistemas utilizados en la producción de medicamentos.
Estas normativas y directrices son esenciales para garantizar que los equipos en la industria farmacéutica operen de manera segura y eficiente, asegurando la calidad de los productos farmacéuticos que llegan a los consumidores.
Consecuencias de no Realizar la Calificación
No seguir adecuadamente estos procesos puede tener consecuencias devastadoras. Puede resultar en la retirada de medicamentos del mercado, lo que conlleva enormes costos financieros. Más importante aún, puede poner en riesgo la salud de los pacientes.
Adicionalmente, la falta de calificación adecuada puede resultar en sanciones regulatorias. Las agencias de salud en todo el mundo tienen estrictas regulaciones para la producción de medicamentos. No cumplir con estas normas puede resultar en multas, sanciones o incluso el cierre de instalaciones.
El proceso de calificación en la industria farmacéutica es un componente esencial para asegurar que los equipos y sistemas funcionen de acuerdo con sus especificaciones y sean adecuados para su propósito previsto. Este proceso se lleva a cabo antes de la validación y es un paso crucial para garantizar la calidad y seguridad de los productos farmacéuticos.
Además de ello, se genera un informe donde hace constar el funcionamiento de los dispositivos o equipos es el óptimo y que estos están adaptados a las expectativas de la industria farmacéutica y que estos cumplan con el sistema de calidad exigido.
Algunos expertos se pregunta cuándo debe realizar la calificación, aquí algunos de los motivos más comunes:
- Para nuevas instalaciones, equipos y servicios públicos.
- Para nuevos sistemas, métodos, procesos y procedimientos.
- Cuándo se realizan cambios, dependiendo del resultado del riesgo evaluación.
- Cuando sea necesario o indicado, según el resultado de evaluaciones periódicas revisión (y puede incluir recalificación y revalidación).

Soluciones Cercal en la Calificación de Equipos en Industria Farmacéutica
En Cercal Group, nos distinguimos por ofrecer soluciones integrales de calificación y validación, enfocadas en garantizar el cumplimiento regulatorio y la calidad en los procesos y equipos de nuestros clientes. Nos dedicamos a brindar una atención detallada y personal, poniendo especial énfasis en las necesidades únicas de cada proyecto, lo que se traduce en una satisfacción y éxito asegurados. Nuestro equipo, compuesto por expertos altamente calificados y con amplia experiencia en la industria, es sinónimo de excelencia y profesionalismo en la ejecución de cada proyecto.
Uno de nuestros pilares es la identificación y gestión proactiva y preventiva de riesgos. Esta aproximación nos permite anticiparnos a posibles desvíos, asegurando el cumplimiento de plazos y objetivos. Este enfoque resulta en un proceso no solo eficiente, sino también efectivo, reflejando nuestro compromiso con la calidad y la adaptabilidad a las demandas del cliente.
Como ya hemos visto a lo largo de este artículo queda claro que la calificación en la industria farmacéutica es fundamental para garantizar la calidad establecida y seguridad de los medicamentos que llegan a manos de los pacientes. Estos procesos de producción, más allá de ser simples requisitos regulatorios, reflejan el compromiso y la responsabilidad de la industria hacia la salud y el bienestar de la sociedad. En un mundo donde la salud es primordial, la trascendencia de estas prácticas no puede ser subestimada, más bien consideradas en todo el rigor que conlleva.
A medida que la industria farmacéutica avanza y se enfrenta a nuevos desafíos, la calificación se adapta y evoluciona, asegurando que los medicamentos sean producidos bajo los más altos estándares de calidad. Es esencial que continuemos promoviendo y adoptando estas prácticas de fabricación de medicamentos, no solo para cumplir con regulaciones, sino para garantizar que cada producto farmacéutico sea confiable y seguro. Con un proceso validado, calificación de equipos, control estadístico y protocolos de validación concurrente.
Comprendemos la importancia de estos procesos y nos enorgullece ser parte de esta industria. Brindamos servicios relacionados, en dispositivos médicos, aire comprimido y autoridades sanitarias. Apoyando a las empresas farmacéuticas en su misión de ofrecer medicamentos de calidad. La validación y calificación en la industria farmacéutica son esenciales, y en Cercal Group, estamos comprometidos con la excelencia en cada paso del camino.


