Contenidos en este artículo
El Informe 45 OMS, publicado tras la reunión del Comité de Expertos en Especificaciones para Preparaciones Farmacéuticas en octubre de 2010, representa un hito crucial en la evolución de las normativas farmacéuticas globales.
Este documento aborda de manera integral las prácticas de calidad y seguridad en la manufactura de medicamentos, marcando un avance significativo hacia la armonización de estándares a nivel internacional.
Surgido de la necesidad de enfrentar desafíos globales en la calidad de los medicamentos, el informe establece directrices claras para la industria, enfocándose en la mejora continua y la gestión de riesgos de calidad.
A lo largo de este blog, explicamos su origen, las actualizaciones clave, su impacto en las regulaciones actuales y su importancia en la garantía de medicamentos seguros y eficaces.
Profundizando en cómo el Informe 45 OMS ha influenciado diversas industrias. No te pierdas nuestras recomendaciones, ideales para empresas en búsqueda de excelencia regulatoria.
Claudia Velasco
CEO Cercal Group
“La implementación del Informe 45 de la OMS marca un antes y un después en la regulación de la calidad farmacéutica, asegurando prácticas más seguras y eficientes en el sector.”
El Origen del Informe 45 de la OMS

El Informe 45 OMS surge como respuesta a crecientes desafíos en la industria farmacéutica para asegurar la calidad y seguridad de los productos farmacéuticos.
La iniciativa, impulsada por la necesidad de estandarizar las prácticas de manufactura y el control de calidad a nivel global, refleja un esfuerzo concertado por armonizar los criterios regulatorios.
Los laboratorios farmacéuticos, enfrentados a variaciones en las exigencias de las entidades regulatorias, demandaban directrices claras y uniformes que facilitaran la producción y distribución de medicamentos seguros.
La convocatoria del comité de expertos, incluyendo a consultores expertos como Jordi Botet, reflejó el compromiso de la OMS con el fortalecimiento del aseguramiento de calidad.
Se buscaba abordar aspectos críticos como la gestión del riesgo, las sustancias farmacéuticas y los productos estériles, elementos esenciales para la protección de la salud pública.
La elaboración del informe estuvo marcada por un proceso inclusivo, donde laboratorios de control, entidades regulatorias y profesionales del sector tuvieron un papel activo, compartiendo experiencias y desafíos.
Este documento no sólo codifica prácticas de manufactura adecuadas, sino que también subraya la importancia del control de calidad a lo largo de toda la cadena de suministro de medicamentos.
Al hacerlo, el Informe 45 sienta las bases para una industria farmacéutica más segura y eficiente, promoviendo la armonización de estándares y facilitando el comercio internacional de productos farmacéuticos.
La relevancia del informe trasciende su marco temporal, ofreciendo una hoja de ruta para el desarrollo futuro de políticas y regulaciones en el sector.
Este esfuerzo colectivo hacia la mejora continua y el fortalecimiento de los sistemas de salud a nivel mundial, demuestra el papel vital de la colaboración internacional en el aseguramiento de la calidad de productos esenciales para la vida.
Publicación y Actualizaciones del Informe 45 OMS
El Informe 45 OMS destaca la importancia de mantener estándares elevados en la calidad farmacéutica.
Desde 1992, con el informe 32, hasta el lanzamiento del informe 45 en 2011, la evolución de las directrices ha sido constante.
Este proceso refleja el compromiso con la seguridad y eficacia de los productos farmacéuticos, a través de:
- Establecimiento de pautas para la manufactura: El informe 32 introdujo normas para la manufactura de productos farmacéuticos.
- Enfatización en la calidad y manufactura para productos no estériles: Actualizado en 2001 con el informe 37, subrayando la calidad en servicios.
- Introducción de revisiones anuales y gestión de riesgo de calidad: Con el informe 45, se destacó la calidad especificada por agencias reguladoras.
Los informes de la OMS han sido fundamentales para guiar a las agencias y laboratorios oficiales de control.
Hacia la adopción de prácticas como las Buenas Prácticas de Laboratorio (BPL) y las Buenas Prácticas de Manufactura (GMP), asegurando productos que cumplan con los más altos estándares de calidad farmacéutica.
Además, los sistemas de calidad han permitido a la industria adaptarse a cambios regulatorios significativos, implementando análisis de riesgo bajo la norma ICH Q9 y mejorando las Buenas Prácticas de Almacenamiento y Distribución (BPA y BPD).
Este enfoque integral hacia la calidad de medicamentos demuestra una adaptación continua a las necesidades globales, marcando un hito en la seguridad y eficacia de los tratamientos disponibles.
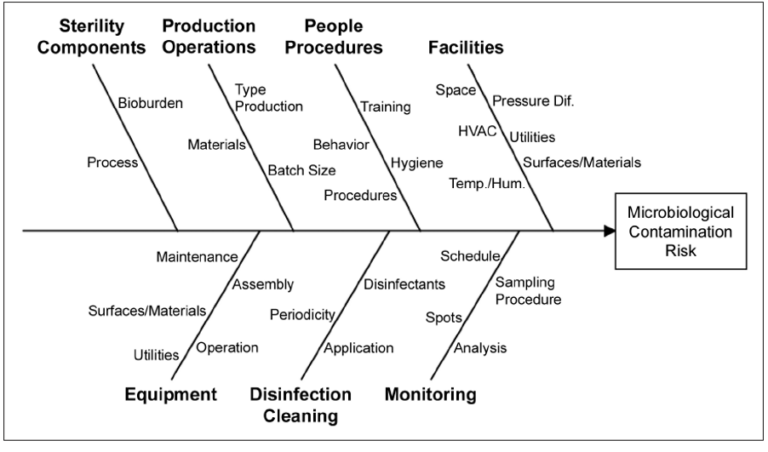
Normativas Antecedentes y el Impacto del Informe 45 de la OMS
La evolución de las normativas de la OMS, especialmente a través del Informe 45, ha sido fundamental en la redefinición del panorama regulatorio en la industria farmacéutica.
Este informe ha introducido cambios significativos en las prácticas de manufactura para medicamentos y sistemas, marcando un antes y un después en comparación con normativas anteriores.
A continuación, se presenta un análisis comparativo y el impacto de estas modificaciones:
- Manufactura Farmacéutica. Antes del Informe 45, las normativas se centraban principalmente en la manufactura de productos bajo criterios generales de calidad. El Informe 45, por su parte, ha enfatizado en la manufactura para sistemas y la manufactura de excipientes, estableciendo estándares más específicos para cada componente del producto farmacéutico.
- Sistemas de Calidad. Previamente, los sistemas de calidad eran vistos como marcos generales sin una aplicación directa en la manufactura farmacéutica. El Informe 45 OMS ha reforzado la necesidad de sistemas de calidad específicos para la industria, promoviendo una mejor integración de estos sistemas en todas las etapas de producción.
- Manufactura para Medicamentos. El impacto del Informe 45 se extiende a la definición de estándares detallados para la manufactura de medicamentos, asegurando que los procesos de producción cumplan con requisitos de calidad más rigurosos, enfocados en la seguridad y eficacia del producto final.
| Aspecto | Antes del Informe 45 | Después del Informe 45 |
| Manufactura de Productos | Enfoque en calidad general | Enfoque en calidad específica por producto |
| Sistemas de Calidad | Marcos generales | Sistemas integrados y específicos para farmacéutica |
| Excipientes | Normativas menos específicas | Directrices claras para la manufactura de excipientes |
| Seguridad y Eficacia | Criterios generales | Estándares rigurosos y específicos |
Este cambio normativo ha significado una mejora en la calidad farmacéutica y un impulso en la calidad para agencias y laboratorios oficiales de control. Promoviendo la manufactura de productos bajo criterios más estrictos y bien definidos.
Aspectos Clave Abordados por el Informe 45 de la OMS
El Informe 45 OMS resalta aspectos cruciales en la mejora de la calidad farmacéutica y la seguridad de los medicamentos. Se centra en la manufactura para sistemas y productos, incluyendo la manufactura de excipientes y la manufactura farmacéutica para medicamentos.
Este informe establece un marco para garantizar la calidad especificada en los servicios y productos, mediante la implementación de sistemas de calidad robustos en laboratorios oficiales de control y en la manufactura de productos farmacéuticos.
Los aspectos clave abordados incluyen:
- Calidad de Medicamentos: Asegura que todos los medicamentos cumplan con los estándares de seguridad y eficacia.
- Calidad en Servicios: Fomenta la mejora continua en la prestación de servicios de salud relacionados con el uso de medicamentos.
- Calidad Especificada: Define los estándares de calidad que deben cumplir los medicamentos y los procesos de manufactura.
- Calidad Farmacéutica: Incluye normas para la correcta fabricación, almacenamiento y distribución de medicamentos.
- Calidad para Agencias: Establece requisitos para que las agencias reguladoras aseguren la disponibilidad de medicamentos seguros y efectivos.
- Laboratorios Oficiales de Control: Refuerza la importancia de la verificación de calidad por parte de laboratorios certificados.
- Sistemas de Calidad: Destaca la necesidad de sistemas de gestión de calidad en todas las etapas de la cadena de suministro de medicamentos.
- Manufactura de Productos: Subraya los estándares de buena manufactura para asegurar la calidad de los medicamentos.
- Manufactura para Productos: Enfatiza en la importancia de prácticas de manufactura específicas para diferentes tipos de productos farmacéuticos.
La implementación de estas directrices es vital para garantizar que los medicamentos disponibles en el mercado sean de la máxima calidad. Seguros para el consumo y eficaces en el tratamiento de enfermedades, contribuyendo así a la salud pública global.
La Importancia del Informe 45 OMS en la Industria Farmacéutica
El Informe 45 OMS ha marcado un hito significativo en la industria farmacéutica, incidiendo de manera crítica en la calidad y seguridad de los medicamentos. Este documento establece estándares y prácticas para la manufactura farmacéutica, abarcando desde los procesos de manufactura hasta el control de calidad.
Su influencia se extiende a la manufactura de productos biológicos, genéricos, naturales, y aquellos de liberación modificada, garantizando que cumplan con los más altos estándares de calidad.

Procesos De Manufactura
El informe enfatiza la importancia de adoptar sistemas de calidad robustos en la manufactura de medicamentos, asegurando la calidad farmacéutica desde la selección de materias primas hasta el producto final.
Esto incluye manufactura para sistemas críticos que afectan directamente la calidad del medicamento, y la manufactura de excipientes, esenciales para la seguridad y eficacia del producto.
Productos Precalificados
La precalificación de productos según el Informe 45 es crucial para la introducción de productos biológicos y genéricos en el mercado, garantizando que cumplen con los requisitos regulatorios internacionales. Esta precalificación actúa como un sello de calidad y seguridad, facilitando su aceptación global.
Innovación y Seguridad
El informe no solo destaca la calidad especificada en la manufactura, sino que también promueve la innovación en el desarrollo de medicamentos.
La inclusión de directrices específicas para productos de liberación modificada refleja el compromiso con la evolución de la farmacología. Y la mejora continua en la administración de fármacos.
Calidad Para Agencias
Para las agencias reguladoras y los laboratorios oficiales de control. El Informe 45 sirve como una referencia crítica, asegurando que los medicamentos cumplan con los requisitos de calidad antes de su aprobación. Esto respalda la toma de decisiones informadas y protege la salud pública.
Impacto Global
El alcance del Informe 45 trasciende las fronteras, estableciendo un marco de trabajo uniforme para la calidad en servicios farmacéuticos a nivel mundial. Facilita la armonización regulatoria y fomenta la cooperación internacional en la vigilancia de la calidad de los medicamentos.
El Informe 45 OMS es piedra angular en la industria farmacéutica. Asegurando que los medicamentos no solo sean efectivos, sino también seguros y de alta calidad. Su implementación es fundamental para proteger la salud de los pacientes y fortalecer la confianza en el sistema de atención médica global.
Aplicación del Informe 45 OMS en Diversas Industrias
El Informe 45 OMS ha ejercido un impacto significativo en diversas industrias. Especialmente en sectores directamente relacionados con la salud y la fabricación de productos farmacéuticos.
Este informe establece estándares y recomendaciones cruciales que afectan a múltiples aspectos de la producción y control de calidad de medicamentos. Asegurando que los productos sean seguros y eficaces para los consumidores.
A continuación, se describen algunos de los sectores más afectados por las regulaciones del informe:
- Industria Farmacéutica. La manufactura de productos farmacéuticos ha sido profundamente influenciada por las directrices del Informe 45. Especialmente en lo referente a las Buenas Prácticas de Manufactura (GMP). Los fabricantes deben adherirse a rigurosos estándares de calidad durante la producción para garantizar la seguridad y eficacia de los medicamentos.
- Laboratorios de Control de Calidad. Los laboratorios oficiales de control y aquellos asociados a la industria farmacéutica deben implementar sistemas de calidad robustos. Para cumplir con los criterios especificados en el informe. Esto incluye la validación de métodos analíticos y la calificación de equipos.
- Industria de Equipos Médicos. La manufactura de dispositivos y equipos médicos también se ve afectada. Ya que deben cumplir con especificaciones de calidad para asegurar que los productos no comprometan la salud del paciente.
- Agencias Reguladoras. Las agencias de regulación de medicamentos a nivel nacional e internacional utilizan el Informe 45 como referencia para establecer sus propios estándares y regulaciones. Esto asegura una armonización global de los criterios de calidad.
- Industrias de Productos Naturales y Suplementos. Aunque el enfoque principal del informe son los medicamentos. Los fabricantes de suplementos alimenticios y productos naturales también deben considerar las recomendaciones del informe. Para garantizar la calidad y seguridad de sus productos.
Sectores – Informe 45 OMS
- Industria farmacéutica (manufactura de medicamentos, incluyendo genéricos y biológicos).
- Laboratorios de control de calidad (tanto oficiales como industriales).
- Fabricantes de equipos médicos.
- Agencias reguladoras nacionales e internacionales.
- Industrias de productos naturales y suplementos dietéticos.
La adopción de las directrices del Informe 45 por estas industrias. Contribuye a elevar los estándares de calidad y seguridad. De los productos de salud disponibles para los consumidores, impactando positivamente en la salud pública global.
Raúl Quevedo
COO Cercal Group
“El Informe 45 de la OMS es un pilar fundamental para el avance hacia un marco regulatorio global más armonizado, que beneficia tanto a productores como a consumidores de medicamentos.”
Recomendaciones para Empresas Bajo el Marco del Informe 45 OMS
El Informe 45 OMS pone énfasis en la mejora continua de la calidad en la industria farmacéutica, ofreciendo recomendaciones claves para las empresas.
Estas recomendaciones buscan fortalecer los sistemas de calidad y asegurar la eficacia y seguridad de los productos farmacéuticos.
Aquí se presentan algunas de las principales sugerencias:
- Adoptar Prácticas Farmacéuticas Avanzadas. Es crucial que las empresas sigan las prácticas farmacéuticas modernas y estén al tanto de las actualizaciones en las regulaciones y estándares de calidad.
- Mejorar la Calidad en Servicios. La calidad no solo debe enfocarse en los productos sino también en los servicios ofrecidos. Asegurando que cumplan con los estándares internacionales y satisfagan las necesidades de los pacientes.
- Aplicación de Criterios de Calidad Especificados. Las especificaciones de calidad deben ser claramente definidas y aplicadas en todos los aspectos de la manufactura y control de calidad.
- Fortalecimiento de los Sistemas de Calidad. Los sistemas de calidad deben ser robustos y capaces de garantizar la consistencia y seguridad de los productos farmacéuticos. A través de todo el proceso de manufactura.
- Manufactura para Productos de Alta Calidad. La manufactura debe seguir estrictamente los procedimientos establecidos. Para asegurar la calidad farmacéutica de los productos, desde la selección de materias primas hasta el producto final.
- Evaluación y Mejora Continua: Las empresas deben implementar un proceso de mejora continua. Evaluando regularmente sus prácticas y sistemas de calidad para identificar áreas de mejora.
- Aplicación del Método de Análisis de Riesgos: La gestión de riesgos debe ser una parte integral de los sistemas de calidad. Identificando, evaluando y mitigando los riesgos asociados a la calidad del producto.
- Capacitación y Desarrollo del Personal: La capacitación continua del personal es esencial para mantener y mejorar los sistemas de calidad.
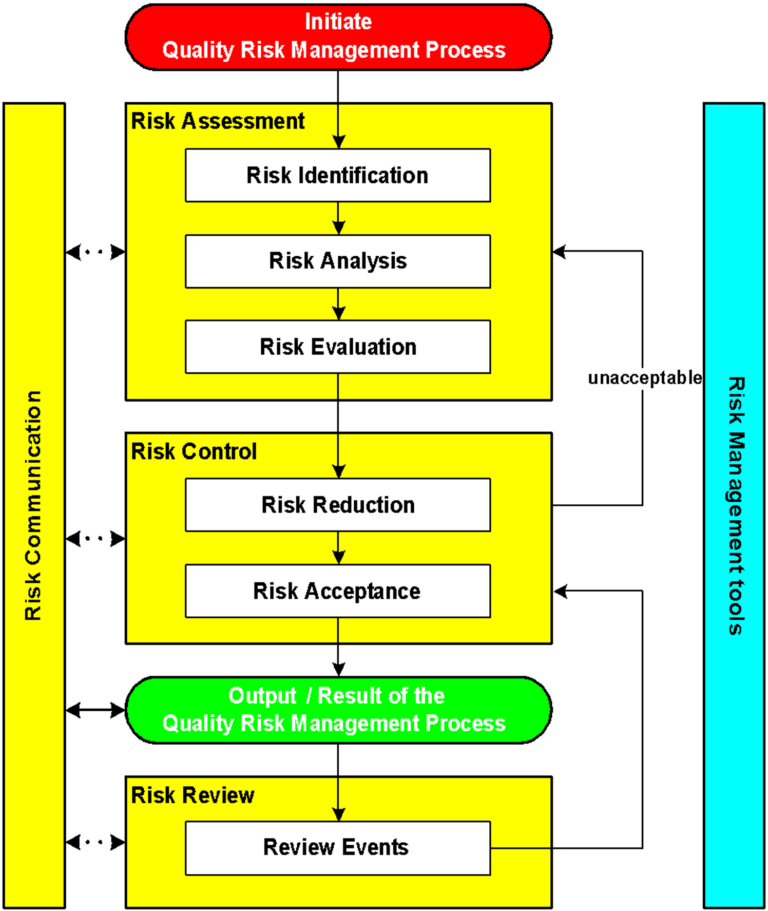
GEP Gestión Farmacéutica: Soluciones Cercal Group
En Cercal Group, entendemos la importancia de adherir al Informe 45 OMS y cómo esto impacta directamente la calidad y seguridad de los productos farmacéuticos.
Nuestros servicios están diseñados para ayudar a las empresas a enfrentar. Y superar los desafíos que plantea cumplir con las demandas altas y las rigurosas exigencias de los entes regulatorios.
Ofrecemos soluciones especializadas para la implementación de sistemas de gestión de calidad que permiten a las empresas mejorar sus procesos industriales.
Estos sistemas están alineados con los estándares y requisitos de organizaciones reconocidas a nivel global. Como la FDA, EMA, OMS, ANVISA, INVIMA, ISP, SAG, ICA, entre otros.
Nuestro objetivo es hacer que tu empresa no solo sea competitiva sino que también cumpla con los más altos estándares de calidad.
Nuestras soluciones integran lineamientos ISO con las exigencias regulatorias regionales. Ofreciendo a nuestros clientes en el sector farmacéutico, salud y alimentos, una manera de simplificar y optimizar los procesos.
La adhesión al Informe 45 OMS asegura que las prácticas de manufactura de tu empresa estén a la vanguardia. Garantizando la eficacia y calidad de los medicamentos producidos.
En Cercal Group, creemos que el cumplimiento de estas regulaciones no solo es una obligación. Es una oportunidad para mejorar la calidad de los productos y procesos. Esto, a su vez, genera un valor tangible para tu empresa, permitiéndote destacar en un mercado altamente competitivo.
Con nuestro apoyo, tu empresa puede lograr la acreditación de competencias, asegurando un compromiso con la excelencia en cada aspecto de la manufactura farmacéutica.
Conclusión
La importancia del Informe 45 OMS trasciende las páginas en las que está escrito. Actuando como un faro para la industria farmacéutica en su búsqueda continua de la excelencia en calidad y seguridad.
Este informe no solo ha establecido un estándar más alto para la manufactura y el control de calidad. Pero también ha redefinido el compromiso de la industria con los procesos de manufactura, asegurando que los productos farmacéuticos no solo cumplan con las expectativas, sino que las superen.
La inclusión de prácticas recomendadas y lineamientos claros ha permitido a las empresas adaptarse a un panorama regulador en constante evolución. Enfocándose en la calidad farmacéutica desde la concepción del producto hasta su entrega final.
La adopción y aplicación del Informe 45 significan para las empresas una oportunidad de liderar en calidad y seguridad. Demostrando su compromiso no solo con los entes reguladores sino, lo que es más importante, con los pacientes que dependen de sus productos.
Los procesos de manufactura, fundamentales para la elaboración de medicamentos seguros y eficaces. Han recibido una atención renovada, subrayando la importancia de una infraestructura sólida, personal capacitado y sistemas de calidad robustos.
Este enfoque integral hacia la calidad en la manufactura farmacéutica no solo mejora la confianza en los productos farmacéuticos. Sino que también establece un modelo a seguir para otras industrias reguladas.
Al final, el Informe 45 OMS no es solo un conjunto de directrices a seguir. Sino una filosofía de mejora continua y excelencia en la calidad. Asegurando que la salud y seguridad de los pacientes siempre estén en el centro de los esfuerzos de la industria.


